Daftar Isi [Tampil]
Parameter kualitas air yang tidak sesuai dapat berakibat fatal bagi kehidupan biota air pada umumnya. Parameter kualitas air yang sangat berpengaruh dalam kehidupan ikan dan udang antara lain adalah :
a. Suhu
Suhu sangat berpengaruh pada proses metabolisme ikan. Suhu perairan yang optimal (sesuai kebutuhan ikan didaerah tropis) adalah 27 – 31 oC. Pada suhu perairan dibawah 25 oC dapat menurunkan kecepatan metabolisme ikan, sehingga ikan akan terhambat pertumbuhannya. Sedangkan bila suhu perairan di atas 35 0C dapat menyebabkan kematian ikan.
b. Dissolved Oxygen (DO)
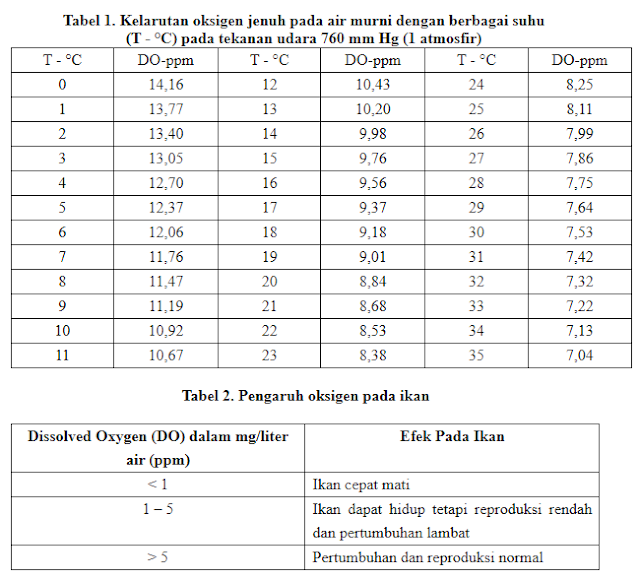
DO atau kelarutan oksigen dalam air merupakan faktor kritis bagi budidaya ikan. Oksigen merupakan kebutuhan pokok bagi biota air pada umumnya.
Kelarutan oksigen tergantung pada;
- Suhu air
- Tekanan udara
- Tekanan uap air
Menurut Brown (1987) peningkatan suhu 1°C akan meningkatkan konsumsi oksigen sekitar 10%. Oksigen berfluktuasi secara harian (diurnal) dan musiman tergantung pada pencampuran (miksin) dan prgerakan (turbulensi) massa air, aktifitas fotosintesis respirasi dan limbah (effluent) yang masuk ke badan air.
Di perairan air tawar, kadar oksigen terlarut antara 15 mg/l pada suhu 0º C dan 8 mg/l pada suhu 25ºC. Oksigen sangatlah diperlukan bagi ekosistem yang dibudidayakan. Adanya oksigen sangatlah berpengaruh pada tingkat ketahanan Ekosistem (ikan) itu sendiri untuk bisa mempertahankan hidup. Kadar oksigen terlarut dalam suatu wadah budidaya ikan sebaiknya berkisar antara 7-9 ppm. Konsentrasi oksigen terlarut ini sangat menentukan dalam aquakultur.
c. pH
Derajat keasaman atau pH adalah ukuran standar perbandingan ion H+ dan ion OH-, bila dalam keadaan normal jumlah kedua jenis ion sama disebut netral ditunjukkan dengan pH = 7. Keadaan dimana pada air lebih banyak ion H+, maka air dinyatakan asam (pH < 7) dan sebaliknya keadaan dimana pada air lebih banyak ion OH-, maka air dinyatakan basa (alkali - pH > 7).
Standard pH yang dibutuhkan pada sebagian besar biota air adalah 6,8 – 8,5. Apabila air menjadi asam, pH dibawah 4 maka ikan akan mengeluarkan banyak lendir yang mengganggu pernafasan, demikian pula bila pH di atas 8. Untuk itu perlu dilakukan pengukuran kualitas air secara berkala untuk menjaga kualitas air pada kondisi yang normal.
d. Alkalinitas
Untuk menjaga pH air tetap stabil pada kisaran 6,8 maka perlu suatu proses kimia yang dinyatakan dalam alkalinitas. Alkalinitas adalah kemampuan pem-bufffer-an dari ion bikarbonat, ion karbonat dan hidroksida dalam air. Ketiga ion tersebut di dalam air akan bereaksi dengan ion hidrogen sehingga dapat menurunkan keasaman atau menaikkan pH. Alkalinitas umumnya dinyatakan dalam satuan ppm (mg/l) kalsium karbonat (CaCO3).
Menurut Effendi (2000), nilai alkalinitas berkaitan dengan jenis perairan.
- Jika perairan dengan nilai alkalinitas kurang dari 40 mg/liter CaCO3 disebut sebagai perairan lunak (soft water).
- Sedangkan perairan yang alkalinitasnya lebih dari 40 mg/liter CaCO3 disebut dengan perairan keras (hard water). Perairan dengan nilai alkalinitas yang tinggi lebih produktif daripada perairan dengan nilai alkalinitas yang rendah.
- Pada umumnya lingkungan yang baik bagi kehidupan ikan adalah dengan nilai alkalinitas di atas 20 ppm.
Bila akan menghendaki penurunan pH pada perairan yang mengandung kapur tinggi, tidak akan efektif kalau hanya dilakukan dengan penambahan asam saja.
Bila hanya dengan penambahan asam saja maka jumlah yang diberikan harus dalam jumlah lebih banyak yaitu untuk mengatasi alkalinitasnya terlebih dahulu, seperti ditunjukkan pada reaksi di atas. Oleh karena itu perlu menurunkan alkalinitas dahulu dengan mendidihkan air atau dengan melalukan air pada gambut. Sedangkan untuk menaikkan alkalinitas dengan menambahkan kalsium karbonat (CaCO3).
e. Kesadahan
Pengaruh kalsium karbonat (CaCO3) dalam air dapat pula dinyatakan sebagai kesadahan yaitu kemampuan air untuk membentuk busa apabila dicampur dengan detergen (sabun).
- Pada air yang mempunyai kesadahan rendah akan mudah membentuk busa apabila dicampur dengan sabun.
- Sedangkan pada air yang mempunyai kesadahan tinggi tidak akan terbentuk busa.
Kesadahan sangat penting bagi kehidupan ikan. Tidak semua ikan dapat hidup pada nilai kesadahan yang sama. Dengan kata lain, setiap jenis ikan memerlukan nilai kesadahan pada kisaran tertentu untuk hidupnya. Disamping itu, kesadahan juga merupakan petunjuk yang penting dalam hubungannya dengan usaha untuk mengubah nilai pH.
Kesadahan pada umumnya dinyatakan dalam satuan ppm (part per million atau satu persejuta bagian) kalsium karbonat (CaCO3), tingkat kekerasan (dH) atau dengan menggunakan konsentrasi molar CaCO3. Satu satuan kesadahan Jerman atau dH sama dengan 10 mg CaO (kalsium oksida) per liter air (10 ppm). Di Amerika, kesadahan pada umumnya menggunakan satuan ppm CaCO3, dengan demikian satu satuan Jerman (dH) dapat diekspresikan sebagai 17,8 ppm CaCO3.
Sedangkan satuan konsentrasi molar dari 1 mili ekuivalen = 2,8 dH = 50 ppm. Perlu diperhatikan bahwa kebanyakan teskit pengukur kesadahan menggunakan satuan CaCO3.
Berikut adalah kriteria kisaran kesadahan yang biasa dipakai:
- 0 - 4 dH, atau 0 - 70 ppm CaCO3 : sangat rendah (sangat lunak)
- 4 - 8 dH, atau 70 - 140 ppm CaCO3 : rendah (lunak)
- 8 - 12 dH, atau 140 - 210 ppm CaCO3 : sedang
- 12 - 18 dH, atau 210 - 320 ppm CaCO3 : agak tinggi (agak keras)
- 18 - 30 dH, aau 320 - 530 ppm CaCO3 : tinggi (keras)
Ketidaksesuaian kesadahan akan mempengaruhi antara lain :
- transfer hara (zat nutrisi)
- hasil sekresi melalui membrane
- kesuburan
- fungsi organ dalam (seperti ginjal, peredaran darah dan lain-lain)
- dan pertumbuhan.
f. Ammonia
Ammonia dalam air dapat berasal dari :
- pemupukan,
- eksresi hewan dan
- hasil perombakan komponen nitrogen oleh mikroba.
Beberapa jenis tanaman dapat menyerap ammonia. Bakteri pengurai (nitrobacter) dapat mengoksidasi ammonia menjadi nitrat. Oleh karena itu ammonia dapat menurun konsentrasinya dengan berbagai cara. Akan tetapi dengan kepadatan ikan yang tinggi dikolam dan pemberian makanan buatan dapat meningkatkan konsentrasi ammonia.
- Ammonia sangat beracun bila dalam bentuk NH3, sedangkan yang sudah terionisai menjadi NH4+ relatif tidak beracun.
Pengaruh Ammonia Pada Perairan adalah :
- Hasil keseimbangan antara ammonia (NH3) dan ammonium (NH4+) adalah total ammonia nitrogen.
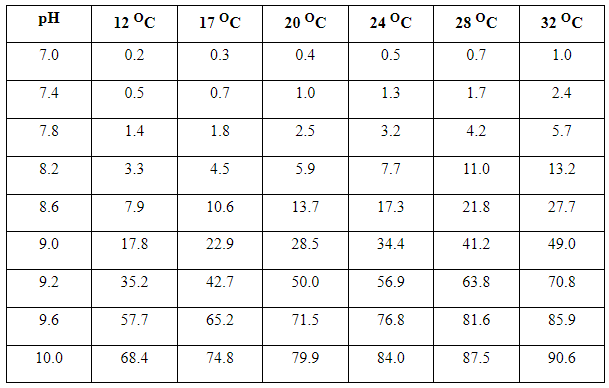
- Keseimbangan total ammonia nitrogen adalah ammonia (NH3) akan bertambah konsentrasinya bila pH dan temperature nya tinggi. Efek yang paling tinggi adalah pengaruh pH dibandingkan pengaruh temperature. Sebagai contoh, pada air yang mempunyai pH 6,8 dan suhu 26° C , 2 mg/l total ammonia nitrogen mengandung ammonia (NH3) 2 mg/l x 0,006 = 0,12 mg/l, sedangkan pada suhu dan air yang sama tetapi dengan pH 9 akan mengandung ammonia (NH3) 2 mg/l x 0,4123 = 0,823 mg/l. Oleh karena itu dengan kenaikan pH akan menyebabkan kenaikan ammonia (NH3).
- Sifat ammonia (NH3) pada ikan adalah dapat meningkatkan konsumsi oksigen dalam jaringan, merusak insang dan mengurangi kemampuan darah untuk mentranportasi oksigen.
- Konsentrasi ammonia yang dapat membunuh ikan dalam waktu singkat adalah 0,6 – 3,1 mg/l NH3-N untuk semua ikan.
- Daya racun ammonia akan meningkat bila oksigen turun. Konsentrasi kalsium (Ca) yang tinggi dapat menurunkan daya racun ammonia.
- Pertumbuhan ikan terhambat bila terjadi akumulasi ammonia pada media pemeliharaan, bahkan dapat menyebabkan keracunan pada ikan.
Tabel 3. Persen dari total amoniak (ppm) yang un-ionized pada berbagai temperatur dan pH.
Efek dari Amoniak Tinggi adalah:
- Terjadinya kerusakan Insang
- Laju pertumbuhan menurun
- Mudah terkena penyakit
- Kenaikan ph darah
- Kerusakan jaringan dan organ bagian internal
- Osmoregulation lemah
- Kematian.
Penyebab Amoniak Tinggi:
- Pemberian pakan yang berlebih
- Pembusukan dari zat organik oleh bakteri.
Cara penanggulangan :
- Mengurangi jumlah pakan
- Pergantian air
- Mengurangi kepadatan ikan
- Pemberian aerasi
- Menurunkan pH kolam
g. Nitrit (NO2ˉ) dan Nitrat (NO3ˉ)
Nitrit mempunyai sifat racun bagi ikan. Pada darah yang banyak mengandung nitrit akan bereaksi dengan haemoglobin membentuk methemoglobin sebagai penyakit darah coklat.
Nitrit terbentuk dari hasil reduksi nitrat oleh bakteri anaerob pada dasar perairan.
- Di perairan nitrit dapat bersifat racun bila konsentrasi lebih dari 5 mg/l NO2ˉ - N.
- Untuk mengatasi tingkat keracunan nitrit dapat ditambahkan kalsium dan klorida pada perairan tersebut.
Amoniak dapat diturunkan konsentrasinya dengan cara :
- Meningkatkan aerator.
- Menghentikan pemberian pakan atau mengurangi jumlah pakan yang diberikan.
- Memeriksa keseimbangan mikrobiologi.
- Bila amoniak meningkat 0.1 ppm, melakukan pergantian 10% dan bila amoniak menjadi 1.0 ppm, melakukan pergantian air 25%. Jangan menggunakan air yang mengandung klorin.
- Memindahkan ikan bila amoniak > 2,5 ppm.
- Mengulangi pemeriksaan setiap 12 – 24 jam
- Menurunkan pH, tetapi tidak sampai dibawah 6
h. Hidrogen Sulfida (H2S)
H2S sangat beracun bagi biota air.Untuk perkembangan penetasan telur dan perkembangan larva konsentrasi hydrogen sulfida (H2S) harus kurang dari 0,019 ppm. Juvenile tidak melebihi 0,045 ppm H2S sedangkan yang sudah dewasa tidak melebihi 0,048 ppm H2S.
i. Plankton
Kelimpahan plankton yang terdiri dari phytoplankton dan zooplankton sangat diperlukan untuk mengetahui kesuburan suatu perairan yang akan dipergunakan dalam kegiatan budidaya. Plankton sebagai organisme perairan tingkat rendah yang melayang-layang di air dalam waktu yang relatif lama mengikuti pergerakan air. Plankton pada umumnya sangat peka terhadap perubahan lingkungan hidupnya (suhu, pH, salinitas, gerakan air, cahaya matahari dll) baik untuk mempercepat perkembangan atau yang mematikan.
Berdasarkan ukurannya, plankton dapat dibedakan sebagai berikut :
- Macroplankton (masih dapat dilihat dengan mata telanjang/ biasa/tanpa pertolongan mikroskop).
- Netplankton atau mesoplankton (yang masih dapat disaring oleh plankton net yang mata netnya 0,03 - 0,04 mm).
- Nannoplankton atau microplankton (dapat lolos dengan plankton net di atas).
Berdasarkan tempat hidupnya dan daerah penyebarannya, plankton dapat merupakan :
- Limnoplankton (plankton air tawar/danau).
- Haliplankton (hidup dalam air asin)
- Hypalmyroplankton (khusus hidup di air payau)
- Heleoplankton (khusus hidup dalam kolam-kolam)
- Petamoplankton atau rheoplankton (hidup dalam air mengalir, sungai).
j. Salinitas
Salinitas air adalah konsentrasi dari total ion yang terdapat didalam perairan.
Pengertian salinitas air yang sangat mudah dipahami adalah
- Jumlah kadar garam yang terdapat pada suatu perairan.
Hal ini dikarenakan salinitas air ini merupakan gambaran tentang padatan total didalam air setelah semua karbonat dikonversi menjadi oksida, semua bromida dan iodida digantikan oleh chlorida dan semua bahan organik telah dioksidasi.
Pengertian salinitas air yang lainnya adalah
- Jumlah segala macam garam yang terdapat dalam 1000 gr air contoh.
Garam-garam yang ada di air payau atau air laut pada umumnya adalah :
- Na,
- Cl,
- NaCl,
- MgSO4 yang menyebabkan rasa pahit pada air laut,
- KNO3 dan lain-lain.
- Salinitas air dapat dilakukan pengukuran dengan menggunakan alat yang disebut dengan refraktometer atau salinometer (Alat Pengukur Salinitas Air).
- Satuan untuk pengukuran salinitas air adalah satuan gram per kilogram (ppt) atau promil (°/оо).
- Nilai salinitas air untuk :
- perairan tawar biasanya berkisar antara 0–5 ppt (Salinitas air Tawar)
- perairan payau biasanya berkisar antara 6–29 ppt (Salinitas air Payau)
- perairan laut berkisar antara 30–35 ppt. (Salinitas air Laut).